Het is ongelofelijk hoeveel kennis er heerst over SARS-CoV2, en toch heeft de opkomst van de Omikron variant iedereen verrast. Ten eerste, stellen we ons nog steeds vragen over zijn oorsprong. Ten tweede was het een raadsel waarom die variant besmettelijker is dan voorgaande varianten en waarom er andere symptomen gepaard gaan met een infectie. Wat weten we en waarover blijven we in het ongewisse?
1. Oorsprong van Omikron.
SARS-CoV2 werd voor het eerst ontdekt in Wuhan (China) in december 2019, vandaar de benaming “Coronavirus Disease-2019” of kortweg Covid-19. Van virussen weten we dat ze snel muteren, bvb van de Wuhan lijn heeft men tijdens het eerste jaar na ontdekking, varianten met 0 tot 5 mutaties in hun Spike eiwit gevonden. Meerdere varianten doken later ook op waaronder:
- De Alpha variant, voor het eerst gedetecteerd in het Verenigd Koninkrijk in oktober 2020 en met 6 of 7 mutaties ten opzichte van de oorspronkelijk Wuhan variant.
- De Beta variant, eerste detectie in Zuid-Afrika in september 2020, die 6 tot 10 mutaties heeft in zijn S eiwit.
- De Gamma variant, gelijktijdig gedetecteerd in Brazilië en Japan in maart 2021 welke in 10 à 12 mutaties verschilt van de oorspronkelijke Wuhan variant.
- En de Delta variant, voor het eerst gedetecteerd in India in januari 2021. Die bezit gemiddeld 9 mutaties (van 3 tot 14) ten opzichte van de Wuhan variant.
- Sinds eind november 2021 hebben we er een nieuwe “variant of concern” bijgekregen, Omikron. Het Omikron virus werd voor het eerst gedetecteerd in Zuid-Afrika, en heeft een 27-tal mutaties in het S-eiwit. Tussenvormen met minder mutaties werden nooit ontdekt of werden althans nooit opgevist uit patiënten. Vandaar dat het ontstaan van deze variant een raadsel is en blijft.
Meerdere theorieën over de oorsprong van Omikron werden vooropgesteld, waarvan een drietal tot op zekere hoogte aannemelijk.
- Misschien is Omikron in een land ontstaan waar weinig screening van patiënten gebeurt. Maar zelfs in de meest afgelegen gebieden of geïsoleerde landen is de PCR test ingeburgerd. Bijgevolg is deze theorie voor de Omikron oorsprong weinig waarschijnlijk.
- Misschien is SARS-CoV2 van mens naar dier overgesprongen (“spill-over”), zoals vroeger gebeurde van mens naar nerts- of katachtigen en een zelfs nijlpaard in de zoo van Antwerpen of herten in Iowa. Daar zou het virus zich verder ontwikkeld hebben en werden mutaties verzameld tot het gemuteerde virus terug oversprong naar mensen. Zo een uitleg is aannemelijk want de Omikron variant bevat een aantal mutaties die maken dat cellen van knaagdieren gemakkelijk geïnfecteerd geraken, zodat muizen of ratten als tussengastheer mogelijks gebruikt werd door SARS-CoV2. Anderzijds is dit onwaarschijnlijk aangezien verwacht wordt dat in een ander gastdier de mutaties verspreid zullen voorkomen, over alle eiwitten van het virus en zulke mutaties buiten het S eiwit zijn niet of nauwelijks aanwezig.
- Het virus heeft een persoon besmet en aanleiding gegeven tot een chronische infectie zonder noemenswaardige symptomen bij een Covid-19 patiënt met een verzwakt immuunsysteem, bvb een hiv-patiënt. Deze theorie wordt ondersteund omdat een jonge Zuid-Afrikaanse vrouw met een ongecontroleerde hiv-infectie, Covid-19 had gedurende 6 maanden. Het virus in haar lichaam had ook meerdere mutaties ondergaan, waarvan er een paar ook voorkomen in Omikron. Een tegenargument haalt men uit ervaringen met influenza en andere virussen in patiënten met een slecht functionerend immuunsysteem. De mutaties die zo in een infectie bij één persoon ontstaan leiden naar varianten die de capaciteit verliezen om besmetting van persoon tot persoon te verwezenlijken. Dus zo een variant zou minder besmettelijk moeten zijn.
Conclusie, voor het ontstaan van Omikron ontbreekt het ons niet aan valabele theorieën, maar wordt elke hypothese onderuitgehaald door gerechtvaardigde tegenargumenten.
2. Waarom is Omikron besmettelijker en (waarschijnlijk) minder ziekmakend, en kunnen we daar iets aan veranderen?
Dat we de oorsprong van Omikron moeilijk bevatten kittelt onze nieuwsgierigheid maar niet veel meer dan dat. Het begrijpen van de hogere besmettingsgraad is veel belangrijker want dat zal ons inzichten verschaffen om de besmettingen aan te pakken en terug te dringen. SARS-CoV2 wordt via de lucht verspreid en komt dus via onze ademhaling binnen in luchtpijp en longen. Daar bindt SARS-CoV2 met zijn S-eiwit op gastheercellen die het ACE-2 eiwit uitdrukken (zie figuur 1). Nu heeft SARS-Cov-2 twee mogelijkheden om de cel binnen te geraken:
Als er furine of TMPRSS2 enzymen in de nabijheid aanwezig zijn op het oppervlak van onze cel dan zullen deze het S-eiwit van het virus knippen. Hierdoor zal de membraan van het virus versmelten met onze celmembraan (TMPRSS2 activatie pad, in figuur 1) en het viraal genomisch RNA (erfelijkheid molecule van het virus te vergelijken met ons DNA) zal in het cytoplasma van de cel terechtkomen. De geïnfecteerde cel zal dan meerdere kopijen van het SARCoV2 aanmaken en uit de cel scheiden.
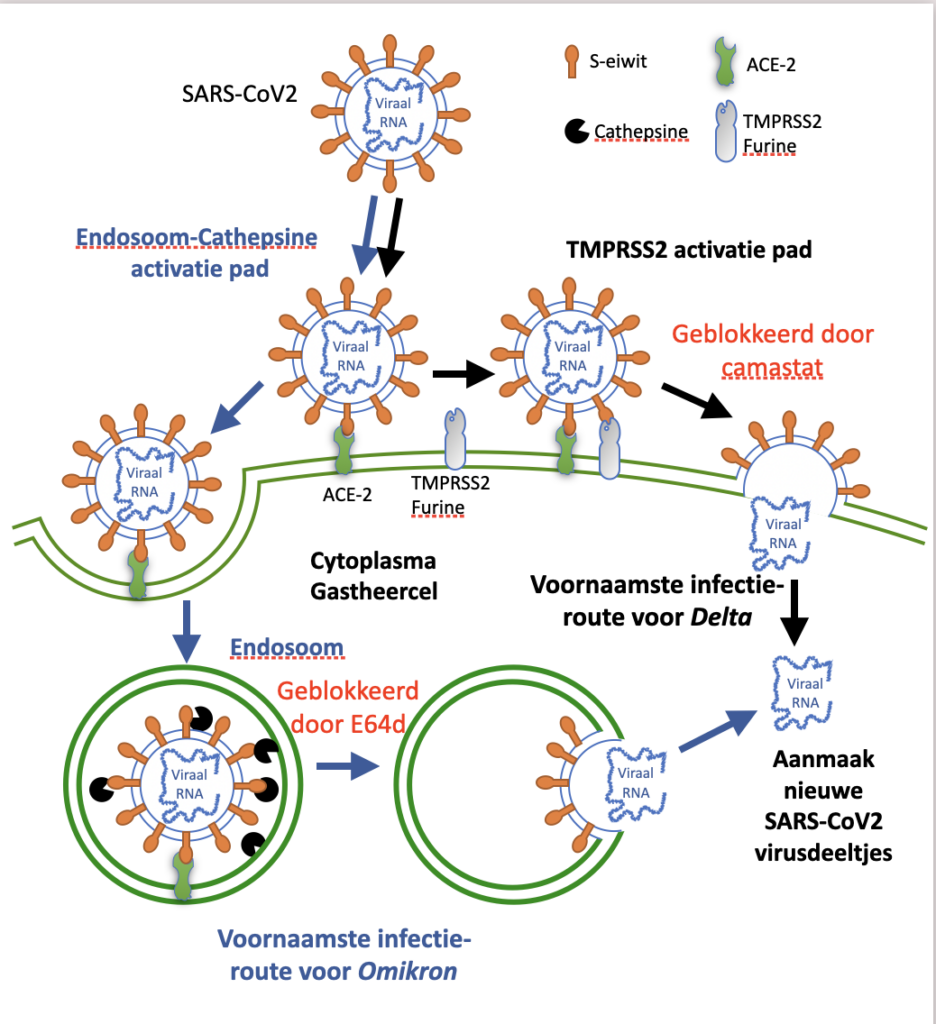
In de tweede mogelijke infectieroute (endosoom-cathepsine activatie pad, figuur 1) wordt het ACE-2 vastgeklikte virus opgeslorpt in een endosoom (een druppeltje als het ware) binnen de cel. Binnen het endosoom zijn cathepsines actief en die breken de membranen van het virus en van het endosoom op zodat het viraal genomisch RNA in het cytoplasma geraakt alwaar het nieuwe virusdeeltjes zal aanmaken.
De toevoeging van TMPRSS2 remmers (bvb camostat) verhindert de opname van de Alpha en de Delta variant, maar niet van Omikron. Anderzijds, remmers van cathepsine (bvb E64d) blokkeren de Omikron opname in cellen. Hierdoor is de endosoom infectieroute duidelijk de voornaamste manier waarop Omikron onze cellen binnendringt. Terwijl Alpha en Delta voornamelijk de voorkeur geeft om via een versmelting van de membranen de cellen te infecteren. De Omikron heeft ook een aantal mutaties in het gedeelte dat door furine of TMPRSS2 herkend wordt, wat aangeeft dat de Omikron membraan moeilijker kan versmelten met de celwand van de gastheercel. De hoeveelheid van TMPRSS2 op cellen in onze hoger en lager geleden luchtwegen is verschillend waardoor Omikron voornamelijk andere cellen zou besmetten, zodat minder complicaties optreden in de longen. Hiermee verklaren we waarom Omikron waarschijnlijk minder ziekmakend is.
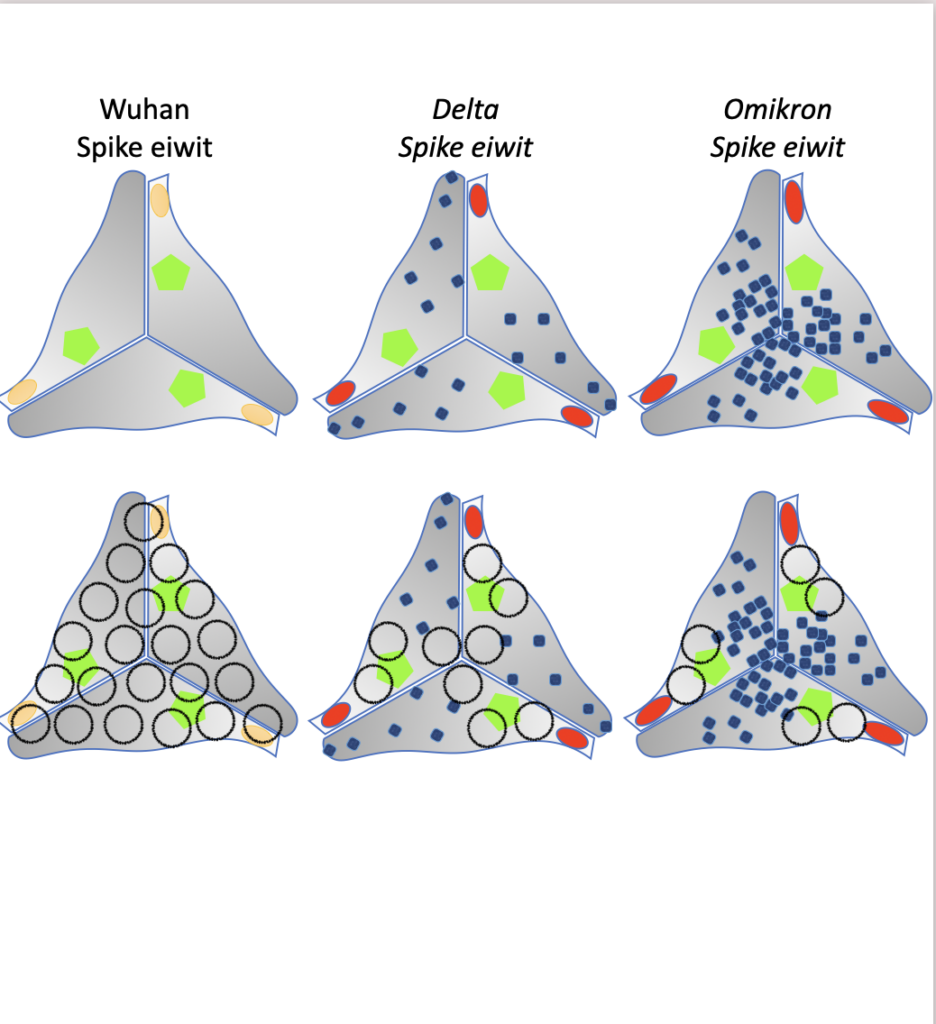
Ook onze vaccinatie draagt bij tot het minder ziekmakend karakter van Omikron. Alhoewel de vaccinatie (zelfs na een boosterprik) geen volledige bescherming biedt tegen de besmetting met Omikron. Met een tweede tekening proberen we dit te verduidelijken (figuur 2). De linkse figuur van het bovenste paneel stelt het S-eiwit voor (eigenlijk bestaat het S eiwit uit 3 identieke eiwitten die aan elkaar kleven, vandaar de 3 driehoekige vormen) met de 3 potentiële bindingssites voor ACE-2 (groene vijfhoek). De middelste figuur stelt het S-eiwit voor van Delta en geeft aan waar de mutaties zich bevinden (blauwe cirkeltjes en furine knippingsplaats in oranje of rood). De rechtse figuur van het bovenste paneel toont de mutaties van Omikron op het S-eiwit. Er zijn duidelijk veel meer mutaties in Omikron dan Delta. Het vaccin dat we met zijn allen gekregen hebben (zowel Johnson, Pfizer, Moderna of AstraZeneca) brengt ons immuunsysteem in contact met het S-eiwit van de Wuhan variant zodat we meerdere antistoffen aanmaken tegen dit S-eiwit. Elk antistof bedekt ongeveer een oppervlakte van ca 0,5 miljoenste van een vierkante millimeter (zwarte cirkels op S-eiwitten in onderste paneel geven aan waar de antistoffen potentieel kunnen binden). Wanneer de antistoffen gebonden zijn aan het S-eiwit dan wordt de herkenning en binding aan ACE-2 verhindert en wordt de infectie geblokkeerd. Een mutatie in het midden van een herkenningsgebied van een antistof zorgt dat dit antistof niet langer het S-eiwit kan binden. In het onderste paneel worden de S-eiwitten van de Wuhan, Delta en Omikron variant getoond met de gebieden die afgeschermd worden door de antistoffen van een gevaccineerd persoon (of iemand die geïnfecteerd werd met de Wuhan variant). Het is duidelijk dat de Omikron variant veel minder herkend wordt door onze anti-Wuhan virus antistoffen, waardoor de gevaccineerden of herstelden van een besmetting onvoldoende beschermd zijn en door het Omikron virus geïnfecteerd geraken. Met een boosterprik probeert men het aantal antistoffen terug te verhogen zodanig dat er toch nog enige bescherming is. Desalniettemin verhinderen de overgebleven efficiënte antistoffen toch dat de besmetting onder controle blijft en niet escaleert tot ernstige ziektesymptomen. Een combinatie van onze vaccins met toekomstige medicijnen zoals camastat of E64d die respectievelijk de TMPRSS2/Furine of cathepsines blokkeren zal de besmettingsgraad van Delta of Omikron verder doen afnemen.
[Een bijdrage van Serge Muyldermans]













